Čo je destilácia? Definícia chémie
Pochopte princípy destilácie
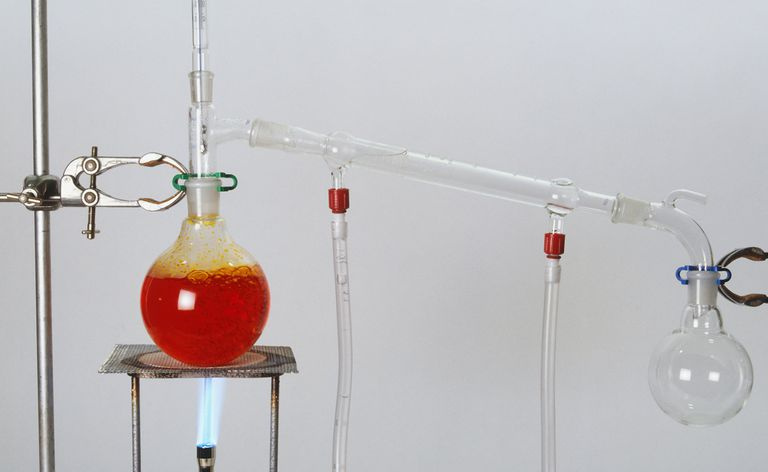
Toto je príklad jednoduchého nastavenia na destiláciu na oddelenie zložiek chemickej zmesi.
Dorling Kindersley/Getty Images
Destilácia je dôležitým separačným procesom v chémii, priemysle a potravinárstve. Tu je definícia destilácie a pohľad na typy destilácie a jej použitie.
Kľúčové veci: destilácia
- Destilácia je proces oddeľovania zložiek zmesi na základe rôznych teplôt varu.
- Príklady použitia destilácie zahŕňajú čistenie alkoholu, odsoľovanie, rafináciu ropy a výrobu skvapalnených plynov zo vzduchu.
- Ľudia používali destiláciu od roku 3000 pred Kristom v údolí Indus.
Definícia destilácie
Destilácia je široko používaná metóda na separáciu zmesí založená na rozdieloch v podmienkach potrebných na zmenu fázy zložiek zmesi. Na oddelenie zmesi kvapalín je možné kvapalinu zahriať, aby sa prinútili zložky, ktoré majú rôzne body varu , do plynnej fázy . Plyn sa potom kondenzuje späť do kvapalnej formy a zbiera sa. Opakovanie procesu na zozbieranej kvapaline na zlepšenie čistoty produktu sa nazýva dvojitá destilácia. Hoci sa tento termín najčastejšie používa pre kvapaliny, opačný proces možno použiť na oddelenie plynov skvapalnením zložiek pomocou zmien teploty a/alebo tlaku.
Zariadenie, ktoré vykonáva destiláciu, sa nazýva a liehovar . Prístroj používaný na vykonávanie destilácie sa nazýva a stále .
História
Najstarší známy dôkaz o destilácii pochádza z terakoty destilačný prístroj datovaný do roku 3000 pred Kristom v údolí Indus v Pakistane. Bolo známe, že destiláciu používali Babylončania z Mezopotámie. Spočiatku sa predpokladá, že destilácia sa používala na výrobu parfumov. K destilácii nápojov došlo oveľa neskôr. Arabský chemik Al-Kindi destiloval alkohol v 9. storočí Irag. Destilácia alkoholických nápojov sa v Taliansku a Číne objavuje bežne od 12. storočia.
Použitie destilácie
Destilácia sa používa v mnohých komerčných procesoch, ako je výroba benzínu, destilovanej vody, xylénu, alkoholu, parafínu, petroleja atď. veľa iných tekutín . Plyn môže byť skvapalnený a oddelený. Napríklad: dusík, kyslík a argón sa destilujú zo vzduchu.
Druhy destilácie
Typy destilácie zahŕňajú jednoduchú destiláciu, frakčná destilácia (rôzne prchavé „frakcie“ sa zhromažďujú pri ich výrobe) a deštruktívna destilácia (zvyčajne sa materiál zahrieva tak, že sa rozloží na zlúčeniny určené na zber).
Jednoduchá destilácia
Jednoduchá destilácia sa môže použiť, keď sa teploty varu dvoch kvapalín navzájom výrazne líšia, alebo na oddelenie kvapalín od pevných látok alebo neprchavých zložiek. Pri jednoduchej destilácii sa zmes zahrieva, aby sa najprchavejšia zložka zmenila z kvapaliny na paru. Para stúpa a prechádza do kondenzátora. Kondenzátor sa zvyčajne chladí (napr. tečúcou studenou vodou okolo neho), aby sa podporila kondenzácia pary, ktorá sa zachytáva.
Parná destilácia
Parná destilácia je používa sa na oddelenie komponentov citlivých na teplo. Do zmesi sa pridá para, čo spôsobí, že sa časť z nej vyparí. Táto para sa ochladí a kondenzuje na dve kvapalné frakcie. Niekedy sa frakcie zhromažďujú oddelene, alebo môžu mať odlišné hodnoty hustoty , takže sa oddelia sami. Príkladom je parná destilácia kvetov za vzniku esenciálneho oleja a destilátu na vodnej báze.
Frakčná destilácia
Frakčná destilácia sa používa, keď sú teploty varu zložiek zmesi blízko seba, ako je určené pomocou Raoultovho zákona . Frakcionačná kolóna sa používa na oddelenie použitých zložiek séria destilácií nazývaných rektifikáciou. Pri frakčnej destilácii sa zmes zahrieva, takže para stúpa a vstupuje do frakcionačnej kolóny. Keď sa para ochladzuje, kondenzuje na výplňovom materiáli kolóny. Teplo stúpajúcej pary spôsobí, že sa táto kvapalina opäť vyparí, čím sa pohybuje pozdĺž kolóny a nakoniec sa získa vzorka s vyššou čistotou prchavej zložky zmesi.
Vákuová destilácia
Vákuová destilácia sa používa na oddelenie zložiek, ktoré majú vysoké body varu. Zníženie tlaku v zariadení tiež znižuje body varu. Inak je proces podobný ako pri iných formách destilácie. Vákuová destilácia je užitočná najmä vtedy, keď normálny bod varu presahuje teplotu rozkladu zlúčeniny.
Zdroje
- Allchin, F. R. (1979). „India: Staroveký domov destilácie?“. Muž . 14 (1): 55-63. doi: 10.2307/2801640
- Forbes, R. J. (1970). Krátka história destilačného umenia od počiatkov až po smrť Celliera Blumenthala . OKULIARE. ISBN 978-90-04-00617-1.
- Harwood, Laurence M.; Moody, Christopher J. (1989). Experimentálna organická chémia: princípy a prax (Ilustrované vyd.). Oxford: Blackwell Scientific Publications. ISBN 978-0-632-02017-1.